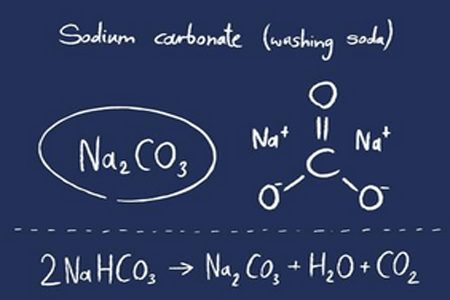
کربنات سدیم (Na2CO3) که با نام های کربنات دو سود، سودا اش (soda ash)، کریستال سودا (soda crystals) و سودای شستشو (washing soda) نیز شناخته می شود، یکی از مهمترین مواد شیمیایی صنعتی بوده که به طور وسیعی در تولید دیگر محصولات قلیایی، نمک های سدیم و … به کار می رود. سودا اش نام متداول کربنات سدیم بدون آب است که به طور صنعتی کاربرد دارد. سدیم کربنات یا سودا اش، در واقع نمک سدیم اسید کربنیک است که در حالت عادی به صورت جامد سفید رنگ می باشد.

سدیم کربنات در مقیاس صنعتی از طریق فرآیند سولوی و با استفاده از سنگ آهک (کلسیم کربنات)، آمونیاک و نمک (سدیم کلرید) تولید می شود. از مهمترین کاربردهای آن می توان به استفاده از این ماده در صنعت تولید شیشه اشاره نمود. خلوص کربنات سدیم معمولاً بر اساس مقدار سدیم اکسید (Na2O) گزارش می شود، به طوری که هر یک کیلوگرم سدیم کربنات دارای 0/585 کیلوگرم اکسید سدیم می باشد.
سدیم کربنات دارای یک بنیان آنیونی (CO3-2) و دو بنیان کاتیونی (+Na) می باشد. شکل های کریستالی این ماده به صورت مونو هیدرات، هپتا هیدرات و دکا هیدرات می باشد. شکل مونو هیدرات آن دارای 85 درصد وزنی سدیم کربنات بوده که به صورت کریستال های کوچک از کریستالیزاسیون محلول اشباع آن در دمای بالاتر از 35 درجه سانتی گراد به دست می آید. شکل هپتا هیدرات آن دارای 45 درصد وزنی سدیم کربنات بوده که در دمای 32 تا 35 درجه سانتی گراد به دست می آید، و شکل دکا هیدرات آن که washing soda نیز نامیده می شود، دارای 37 درصد وزنی سدیم کربنات است و در دمای پایین تر از 32 درجه سانتی گراد به دست می آید.

معمولاً سدیم کربنات به صورت هپتا هیدرات وجود دارد که به سهولت به شکل پودر سفید مونو هیدرات در می آید. کربنات سدیم دارای خاصیت قلیایی نسبتاً قوی بوده و از خاکستر بسیاری از گیاهان قابل استحصال است. پیشینه مصرف این ماده توسط انسان به بیش از 5000 سال باز می گردد، به طوری که مصریان باستان از شکل طبیعی نمک قلیایی ترکیبی از سدیم کربنات دکا هیدرات و سدیم بی کربنات (سدیم هیدروژن کربنات یا جوش شیرین) استفاده می کردند. آن ها این نمک قلیایی را به عنوان صابون شستشو به کار می بردند، همچنین در تولید شیشه نیز از آن بهره می بردند.
در سال 1791 میلادی شیمیدان فرانسوی نیکلاس لبانس توانست کربنات سدیم را با استفاده از نمک سدیم کلرید، سولفوریک اسید و سنگ آهک (کلسیم کربنات) در حضور زغال تهیه نماید. در روش پیشنهادی وی ابتدا نمک سدیم کلرید در سولفوریک اسید جوشانده می شد تا به سدیم سولفات و گاز هیدروژن کلرید تبدیل شود، سپس سدیم سولفات تولید شده به همراه سنگ آهک و زغال خرد شده حرارت داده می شد تا سدیم کربنات حاصل گردد. لازم به ذکر است که گاز هیدروژن کلرید (هیدروکلریک اسید) حاصل از این واکنش به عنوان یک منبع آلودگی هوا به شمار می آمد، اما با این وجود از این روش برای تولید کربنات سدیم تا اواخر دهه 1880 میلادی استفاده می شد.
خواص فیزیکی و شیمیایی سدیم کربنات
سدیم کربنات دارای نقطه ذوب 851 درجه سانتی گراد می باشد، و در دماهای بالاتر تجزیه می شود؛ لذا نقطه جوش برای آن تعریف نمی شود. حلالیت سدیم کربنات در آب در دمای 20 درجه سانتی گراد برابر 220 گرم در لیتر است.
سایر خواص فیزیکی و شیمیایی
از واکنش های شیمیایی سدیم کربنات می توان به واکنش آن با کربنیک اسید (کربن دی اکسید و آب) که منجر به تولید سدیم بی کربنات (سدیم هیدروژن کربنات) می شود، اشاره نمود.
![]()
همچنین سدیم بی کربنات در حضور سدیم هیدروکسید (سود پرک)، سدیم کربنات تولید می کند.
فرآیند های تولید سدیم کربنات
به طور کلی دو روش برای تولید سدیم کربنات وجود دارد که عبارتند از:
1- سنتز شیمیایی سدیم کربنات به روش سولوی (Solvay)
2- استحصال سدیم کربنات از منابع طبیعی
فرآیند تولید کربنات سدیم به روش سولوی
در سال 1861 میلادی شیمیدان بلژیکی به نام ارنست سولوی، روشی را برای سنتز سدیم کربنات معرفی نمود که در آن از نمک سدیم کلرید و سنگ آهک (کلسیم کربنات) به عنوان مواد اولیه و از آمونیاک به عنوان کاتالیزور استفاده می شود.
![]()
مرحله اول: تولید سدیم بی کربنات (سدیم هیدروژن کربنات)
در این روش ابتدا نمک سدیم کلرید را در آب حل می کنند تا محلول اشباع نمک به دست آید، سپس انجام واکنش به وسیله عبور محلول اشباع نمک از درون دو برج متوالی می باشد که در برج اول حباب های آمونیاک از پایین برج به سمت بالا آمده و توسط محلول آب نمک جذب و حل می شود. در برج دوم با تزریق گاز دی اکسید کربن، حباب های این گاز از محلول آب نمک آمونیاکی عبور کرده و سدیم بی کربنات (سدیم هیدروژن کربنات یا جوش شیرین) حاصل می شود.
![]()
دی اکسید کربن مورد نیاز این مرحله از تجزیه حرارتی سنگ آهک (کلسیم کربنات) به دست می آید.
![]()
در اثر حرارت دادن سنگ آهک، علاوه بر دی اکسید کربن، اکسید کلسیم نیز به دست می آید که از آن در بخش بازیافت آمونیاک استفاده خواهد شد. محصول حاصل از این فرآیند سدیم بی کربنات و محلول آمونیوم کلرید می باشد که با عبور از فیلتر، بی کربنات سدیم آن جدا شده و به مرحله بعدی تولید کربنات سدیم منتقل می شود.
مرحله دوم: تولید سدیم کربنات
بی کربنات سدیم حاصل از فرآیند مرحله اول، به روش حرارتی (کلسیناسیون) در دمای حدود 200 درجه سانتی گراد، با از دست دادن آب و دی اکسید کربن، به کربنات سدیم تبدیل می شود. لازم به ذکر است که دی اکسید کربن حاصل شده در این مرحله به منظور استفاده مجدد، به مرحله اول برگشت داده می شود.
مرحله سوم: بازیافت آمونیاک
در بخش جانبی این فرآیند، آمونیوم کلرید (نشادر) با اکسید کلسیم حاصل از فرآیند تجزیه حرارتی سنگ آهک (کلسیم کربنات)، واکنش داده می شود و آمونیاک احیا شده و به مرحله اول واکنش برگشت داده می شود. همچنین محصول جانبی این فرآیند، کلرید کلسیم می باشد که قابل فروش می باشد.
![]()
(لازم به ذکر است با توجه به شرایط خاک کشاورزی در کشورهای مختلف، می توان به جای بازیافت آمونیاک محصول آمونیوم کلرید را مستقیماً به عنوان یک کود شیمیایی به فروش رساند.)
مواد اولیه در فرآیند تولید سدیم کربنات به روش سولوی
مواد اولیه مورد نیاز برای تولید کربنات سدیم به روش سولوی عبارتند از: سنگ آهک (کلسیم کربنات)، نمک سدیم کلرید و آمونیاک
سنگ آهک (کلسیم هیدروکسید)
سنگ آهک (CaCO3) مصرفی در فرآیند تولید سدیم کربنات می بایست دارای خلوص حداقل 84 درصد باشد. اما از آنجا که به توجه به کیفیت معدن، خلوص سنگ آهک متفاوت می باشد، لذا میزان مصرف آن در فرآیند تولید کربنات سدیم متفاوت می باشد. میزان مصرف آن با توجه به کیفیت سنگ آهک (84 درصد تا 98 درصد) در حدود 1820- 1090 کیلوگرم به ازای تولید هر تن محصول برآورد می شود.
نمک سدیم کلرید
نمک مصرفی در این فرآیند نیز بسته به کیفیت آن در حدود 1800- 1530 کیلوگرم به ازای تولید هر تن محصول در نظر گرفته می شود.
آمونیاک
از آنجا که آمونیاک در این فرآیند مصرف نمی شود و نقش کاتالیزور را دارد، لذا در فرآیند بازیافت به چرخه باز می گردد. اما فرض می شود که آمونیاک در حدود 0/5 درصد در فرآیند مصرف شده باشد، بر این اساس با توجه به این که میزان مصرف آمونیاک در فرآیند تولید کربنات سدیم 550 کیلوگرم به ازای هر تن محصول می باشد، لذا میزان مصرف آن در حدود 2/75 کیلوگرم به ازای هر تن محصول محاسبه می گردد.
استحصال سدیم کربنات از منابع طبیعی
در این روش از ترکیبات معدنی همچون ترونا و نفلین که حاوی سدیم کربنات و سدیم بی کربنات می باشند بهره برداری می شود. این روش در کشورهایی مانند آمریکا و ترکیه که دارای ذخایر بزرگ ترونا هستند، استفاده می شود.
کاربردهای سدیم کربنات

کربنات سدیم از جمله موادی است که کاربردهای زیاد و متنوعی در صنایع مختلف دارد. برخی از مهمترین کاربردهای آن به شرح ذیل می باشد:
1- ساخت و تولید شیشه
مهمترین و اصلیترین کاربرد سدیم کربنات در تولید شیشه است. استفاده از این ماده در شیشه سازی موجب کاهش دمای تشکیل شیشه و صرفه جویی در مصرف انرژی می گردد.
2- تولید مواد شیمیایی
از کربنات سدیم در تولید برخی مواد شیمیایی از جمله سدیم بی کربنات (سدیم هیدروژن کربنات)، سدیم سیلیکات، سدیم تری پلی فسفات، سدیم دی کرومات، سدیم آلومینات، سدیم سیانید و … استفاده می شود.
3- تولید کاغذ
در صنعت تولید کاغذ از کربنات سدیم به عنوان عامل تنظیم کننده اسیدیته و همچنین به منظور رنگ زدایی از کاغذ باطله مورد استفاده قرار می گیرد.
4- تولید صابون و شوینده ها (دترجنت ها)
از سدیم کربنات در تولید صابون و شوینده ها (دترجنت ها) به عنوان عامل آلکالی (قلیایی) استفاده می گردد.
5- نرم کردن آب
در فرآیند تبادل یونی موجب حذف یون های کلسیم و منیزیم از آب شده و موجب کاهش سختی آب می گردد. لذا در مصارف گوناگون موجب کاهش مصرف شوینده می شود. (بدون استفاده از کربنات سدیم، شوینده اضافی برای مرطوب نمودن یون های کلسیم و منیزیم نیاز می شود)
6- مخازن آب شهری
به عنوان یک افزودنی متداول در مخازن آب شهری به منظور خنثی سازی اثر اسیدی کلر و افزایش pH به کار می رود.
7- رنگرزی
از کربنات سدیم به عنوان عامل استحکام دهنده پیوند بین رنگ و الیاف استفاده می شود.
8- صنایع غذایی
در صنایع غذایی از سدیم کربنات به عنوان تنظیم کننده pH و نگهدارنده استفاده می شود.
9- صنایع الکترولیز
به عنوان یک الکترولیت باعث افزایش سرعت تجزیه آب می شود.
10- تاکسیدرمی
در فرآیند حذف گوشت از استخوان ها کاربرد دارد.
11- آزمایشگاه های شیمی
در آزمایشگاه های شیمی از سدیم کربنات به عنوان استاندارد اولیه در واکنش های تیتراسیون استفاده می شود.
12- خمیر دندان
در ساخت خمیر دندان کربنات سدیم به عنوان عامل افزایش دهنده pH دهان و عامل کف ساز به کار می رود.
13- آجر سازی
به عنوان عامل مرطوب کننده در تولید خمیر موجب کاهش مقدار آب مصرفی می شود.
14- صنعت نساجی
در صنعت نساجی از کربنات سدیم به عنوان عامل ضد اسید در فرآوری ابریشم استفاده می شود.
15- صنایع پتروشیمی و تصفیه نفت خام
به عنوان خنثی کننده در فرآیندهای پتروشیمی کاربرد دارد.
16- تصفیه روغن های گیاهی
سدیم کربنات در تصفیه روغن های گیاهی به عنوان عامل جداکننده اسیدهای چرب آزاد عمل می کند.
تأثیر زیست محیطی سدیم کربنات
اصلی ترین اثر نامطلوب کربنات سدیم بر محیط زیست را می توان تأثیر آن را بر pH محیط در نظر گرفت. لذا تأثیر نامطلوب سدیم کربنات بر ارگانسیم های موجود در محیط تا حد زیادی تابع ظرفیت بافری محیطی است که این ماده در آن رها می شود. بررسی ها نشان داده اند که کربنات سدیم در غلظت های کمتر از 100 میلی گرم بر لیتر بی خطر بوده و در صورتی که این ماده را قبل از انتقال به محیط زیست رقیق کنیم حتی به صورت موضعی نیز موجب کاهش pH نخواهد شد. همچنین بلعیدن کربنات سدیم بدون ضرر است مگر این که به مقدار خیلی زیاد باشد. بو کردن آن نیز ممکن است موجب سوزش بینی و یا گلو شود. در اثر تماس با پوست های حساس ممکن است موجب خارش و یا سوزش پوست گردد. در اثر تماس با چشم امکان ایجاد سوزش و سرخی در چشم وجود دارد. به طور کلی اثرات ایمنی نامطلوب این ماده بیشتر به دلیل ذرات ریز آن می باشد که ممکن است وارد بینی، چشم و یا گلو شوند.
23 دیدگاه. ارسال دیدگاه جدید
سلام.برایم سوال است کهچگونه ممکن است نمک باز یا اسید باشد؟ مگر کربنات سدیم نمک نیست.چرا آن را باز می دانید
سلام و درود؛ نمک ها پس از انحلال در آب می توانند خاصیت اسیدی و یا قلیایی داشته باشند. در نمک سدیم کربنات به دلیل ایجاد یون سدیم، خاصیت قلیایی ایجاد می کند.
سلام چرا سدیم هیدروژن کربنات خاصیت بازی داره؟
بادرود
برای نرم کردن آب کشاورزی میتوان از هیدروکسید سدیم استفاده کرد ؟
و اینکه آیا تمامی انواع سدیم یون کلسیم و منیزیم را از بین می برند ؟
و آیا هیدروکسید سدیم کلسیم و منیزیم همه مایعات را حذف می کنند مثلاً ملاس ( تفاله چغندر قند البته به صورت مایع هستش)
یا مثلاً کود های زیر مغذی مایع ، که داخلش کلسیم و منیزیم هست ؟
با تشکر 🙏🏻🙏🏻🙏🏻
سلام و احترام؛ درباره کودها اطلاعات جامعی ندارم اما از سدیم هیدروکسید برای نرم کردن آب استفاده نمی شود. شما با این کار pH آب را به شدت بالا می برید که ممکن است برای مصرف مورد نظرتان اصلا مناسب نباشد.
بسیار مقاله خوبی بود
خدا قوت
فقط اگر یک نکته رو هم در خصوص فرایند تولید، اضافه کنید، به غنای مطلب خواهد افزود
کربنات سدیم به روشهای مختلفی سنتز میشود که متداولترین روش، فرآیند سولوی می باشد (اینطور نیست که فقط به روش سولوی تولید بشه، فرآیند Leblanc هم داریم، روشهای دیگر هم هست)
سلام
ایا کلوخه شدن کربنات سدیم در اثر تماس با اب باعث خراب شدن ان می گردد یا میتوان مجددا از ان استفاده نمود ؟
سلام و درود، پیشنهاد می کنم ویدئو زیر را مشاهده بفرمایید.
https://www.youtube.com/watch?v=7bQPH2AKtcI
سلام چگونه میتوانم کربنات سدیم فلز را جدا کنم
سلام مهران عزیز، متوجه پرسش شما نشدم.
عجب پیج خفنی دارید. لذت بردم. چون عاشق شیمی هستم. دست مریزاد
مطالب خوبی بود ،مختصر و مفید. موفق باشید.
خوشحالیم که مطالب ارائه شده مورد توجه شما قرار گرفته است.
من میخوام یه واحد کوچک تولید سدیم کربنات با ظرفیت ۵تن در روز احداث کنم نظر شما چیه؟
سلام و درود، اولین نکته در راه اندازی یک واحد تولیدی مطالعه بازار می باشد و در ادامه ایجاد و بررسی یک طرح توجیهی قابل استناد، لذا بدون در اختیار داشتن اطلاعات لازم هیچگونه اظهار نظری نمی توان نمود.
آقای خالق عزیز، واحدهای کربنات سدیم که در کشور فعال هستند، همگی بالای 1000 تن در روز ظرفیت دارند، حداقل ظرفیت پیشنهادی 600 تن در روز میباشد
واحدهای کوچکتر دارای سودآوردی کمتری هستند
سلام و عرض ادب خدمت استاد عزیز جناب آقای مهندس رجبی مهر
اخیراً پیشنهاد استفاده از نمک های دریاچه ارومیه به منظور تهیه کربنات دو سود سبک مطرح شده است. لطفاً اظهار نظر بفرمایید.
سپاسگزارم
سلام و درود، جناب آقای مهندس گل محمدی عزیز تا جایی که بنده اطلاع دارم نمک های موجود در دریاچه ارومیه عمدتاً حاوی منیزیم و پتاسیم می باشد. لذا استخراج نمک سدیم کربنات قطعاً نیاز به انجام بررسی و مطالعات ببیشتری دارد. موفق و پیروز باشید
آقای گل محمدی، نمک یکی از مواد اولیه مصرفی برای تولید کربنات سدیم هستش و همین الان هم این کار در کارخانه کاوه سودای شهر مراغه داره انجام میشه
سلام و ممنون از اطلاعات مفيدتون.
ايا جهت افزايش قلياييت اب اشاميدني ميتوان به همراه سود خوراكي استفاده كرد؟
سلام و احترام، دوست عزیز سوال شما را به درستی متوجه نشدم، اصولاً آب آشامیدنی قلیایی نیست و سود (سدیم هیدروکسید یا سود سوزآور) برای مصارف خوراکی به طور مستقیم کاربردی ندارد.
سلام و ممنون از اطلاعات مفید شما
سؤالی داشتم از خدمتتون اینکه در مورد تهیه سودا اش یا همان کربنات سدیم،ایا میتوان با جوشاندن جوش شیرین،سودا اش بدست آوریم ؟
از راهنمایی شما سپاسگزارم
سلام و درود، شما می توانید با حرارت دادن سدیم بی کربنات (سدیم هیدروژن کربنات یا جوش شیرین)، سدیم کربنات تهیه کنید. ویدئو مربوطه را در این صفحه مشاهده بفرمایید. https://iranchembook.ir/directory/sodium-carbonate/