بی کربنات سدیم (NaHCO3) جامدی کریستالی به رنگ سفید است که با نام های دیگری همچون سدیم هیدروژن کربنات، جوش شیرین، Baking Soda ،Cooking Soda ،Bread Soda و یا Bicarbonate Soda نیز شناخته می شود. این نمک در آب محلول است و حلالیت آن در حضور کربنات سدیم کاهش می یابد، و به صورت مخلوط در بسیاری از مواد معدنی نیز یافت می شود.

فرآیند های تولید بی کربنات سدیم
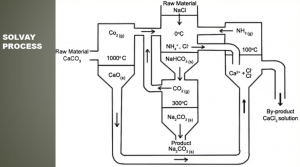
1- سنتز شیمیایی بی کربنات سدیم به روش سولوی (Solvay)
این روش متداول ترین فرآیند صنعتی تولید بی کربنات سدیم می باشد.
2- از طریق استحصال سدیم کربنات از منابع طبیعی
در این روش از طریق استحصال از منابع طبیعی ترونا (Trona، سنگ معدن حاوی کربنات سدیم) ابتدا سدیم کربنات حاصل می شود که در ادامه به سدیم بی کربنات تبدیل می شود.
3- روش Airborne
4- روش Carbonor
این روش تنها در برزیل مورد استفاده قرار گرفته است.
5- واکنش بین گاز دی اکسید کربن و محلول آبی سدیم هیدروکسید
از واکنش گاز دی اکسید کربن و محلول آبی سدیم هیدروکسید (سود سوزآور یا سودپرک) ابتدا کربنات سدیم تولید می شود:
 با افزودن مقدار بیشتری گاز دی اکسید کربن به محلول حاصل، بی کربنات سدیم تولید می شود که به دلیل غلظت بالا ته نشین می گردد:
با افزودن مقدار بیشتری گاز دی اکسید کربن به محلول حاصل، بی کربنات سدیم تولید می شود که به دلیل غلظت بالا ته نشین می گردد:
 در ادامه به بررسی تولید بی کربنات سدیم از طریق روش سولوی و استحصال از منابع معدنی خواهیم پرداخت.
در ادامه به بررسی تولید بی کربنات سدیم از طریق روش سولوی و استحصال از منابع معدنی خواهیم پرداخت.
سنتز سدیم بی کربنات با فرآیند سولوی
در سال 1861 میلادی شیمیدان بلژیکی به نام ارنست سولوی، روشی را برای سنتز سدیم کربنات معرفی نمود که در آن از نمک سدیم کلرید و سنگ آهک (کلسیم کربنات) به عنوان مواد اولیه و از آمونیاک به عنوان کاتالیزور استفاده می شود.
 اهمیت این فرآیند به دلیل وجود مواد اولیه فراوان و ارزان می باشد که منجر به تولید محصولات ارزشمندی همچون سدیم کربنات و سدیم بی کربنات می گردد. البته ذکر این نکته نیز ضروری است که در سال های اخیر تنها حدود 15 درصد از کل تولید سدیم بی کربنات دنیا از طریق سنتز شیمیایی به دست آمده است و بخش اعظم این محصول از طریق استحصال از سنگ معدن ترونا به دست می آید.
اهمیت این فرآیند به دلیل وجود مواد اولیه فراوان و ارزان می باشد که منجر به تولید محصولات ارزشمندی همچون سدیم کربنات و سدیم بی کربنات می گردد. البته ذکر این نکته نیز ضروری است که در سال های اخیر تنها حدود 15 درصد از کل تولید سدیم بی کربنات دنیا از طریق سنتز شیمیایی به دست آمده است و بخش اعظم این محصول از طریق استحصال از سنگ معدن ترونا به دست می آید.
مرحله اول: تولید بی کربنات سدیم (سدیم هیدروژن کربنات)
در این روش ابتدا نمک سدیم کلرید را در آب حل می کنند تا محلول اشباع نمک به دست آید، سپس انجام واکنش به وسیله عبور محلول اشباع نمک از درون دو برج متوالی می باشد که در برج اول حباب های آمونیاک از پایین برج به سمت بالا آمده و توسط محلول آب نمک جذب و حل می شود. در برج دوم با تزریق گاز دی اکسید کربن، حباب های این گاز از محلول آب نمک آمونیاکی عبور کرده و بی کربنات سدیم (سدیم هیدروژن کربنات یا جوش شیرین) حاصل می شود.
دی اکسید کربن مورد نیاز این مرحله از تجزیه حرارتی سنگ آهک (کلسیم کربنات) به دست می آید.
مورد نیاز این مرحله از تجزیه حرارتی سنگ آهک (کلسیم کربنات) به دست می آید.
 در اثر حرارت دادن سنگ آهک، علاوه بر دی اکسید کربن، اکسید کلسیم نیز به دست می آید که از آن در بخش بازیافت آمونیاک استفاده خواهد شد. محصول حاصل از این فرآیند، بی کربنات سدیم و محلول آمونیوم کلرید می باشد که با عبور از فیلتر، بی کربنات سدیم آن جدا شده و به مرحله بعدی تولید کربنات سدیم منتقل می شود.
در اثر حرارت دادن سنگ آهک، علاوه بر دی اکسید کربن، اکسید کلسیم نیز به دست می آید که از آن در بخش بازیافت آمونیاک استفاده خواهد شد. محصول حاصل از این فرآیند، بی کربنات سدیم و محلول آمونیوم کلرید می باشد که با عبور از فیلتر، بی کربنات سدیم آن جدا شده و به مرحله بعدی تولید کربنات سدیم منتقل می شود.
مرحله دوم: تولید سدیم کربنات
بی کربنات سدیم حاصل از فرآیند مرحله اول، به روش حرارتی (کلسیناسیون) در دمای حدود 200 درجه سانتی گراد، با از دست دادن آب و دی اکسید کربن، به کربنات سدیم تبدیل می شود.
 مرحله سوم: تولید بی کربنات سدیم
مرحله سوم: تولید بی کربنات سدیم
در این مرحله با عبور دادن گاز دی اکسید کربن از محلول اشباع کربنات سدیم، محصول نهایی بی کربنات سدیم رسوب نموده و تولید می شود.
 بازیافت آمونیاک
بازیافت آمونیاک
در بخش جانبی این فرآیند، آمونیوم کلرید (نشادر) با اکسید کلسیم حاصل از فرآیند تجزیه حرارتی سنگ آهک (کلسیم کربنات)، واکنش داده می شود و آمونیاک احیا شده و به مرحله اول واکنش برگشت داده می شود. همچنین محصول جانبی این فرآیند، کلرید کلسیم می باشد که قابل فروش می باشد.
 اگر چه همانطور که ملاحظه می شود، در مرحله دوم طی فرآیند تولید کربنات سدیم، بی کربنات سدیم نیز به عنوان یک محصول جانبی تولید می گردد. اما بر اساس تحقیقات و بررسی های صورت گرفته تولید بی کربنات سدیم از کربنات سدیم بسیار اقتصادی تر است از این که بی کربنات سدیم را در مرحله دوم سنتز کربنات سدیم جداسازی و خالص سازی شود.
اگر چه همانطور که ملاحظه می شود، در مرحله دوم طی فرآیند تولید کربنات سدیم، بی کربنات سدیم نیز به عنوان یک محصول جانبی تولید می گردد. اما بر اساس تحقیقات و بررسی های صورت گرفته تولید بی کربنات سدیم از کربنات سدیم بسیار اقتصادی تر است از این که بی کربنات سدیم را در مرحله دوم سنتز کربنات سدیم جداسازی و خالص سازی شود.
{"id":175,"instanceName":"Player 1 (copy)","videos":[{"videoType":"HTML5","mp4HD":"https:\/\/dl.iranchembook.ir\/video-b\/009-Preparation-Of-Baking-Soda.mp4","mp4SD":"","thumbImg":"thumbImg","title":"\u0631\u0648\u0634 \u062a\u0647\u06cc\u0647 \u0633\u062f\u06cc\u0645 \u0628\u06cc \u06a9\u0631\u0628\u0646\u0627\u062a","description":"description","info":"info","enable_mp4_download":"no","prerollAD":"no","prerollGotoLink":"prerollGotoLink","preroll_mp4":"preroll_mp4","prerollSkipTimer":"prerollSkipTimer","midrollAD":"no","midrollAD_displayTime":"midrollAD_displayTime","midrollGotoLink":"midrollGotoLink","midroll_mp4":"midroll_mp4","midrollSkipTimer":"midrollSkipTimer","postrollAD":"no","postrollGotoLink":"postrollGotoLink","postroll_mp4":"postroll_mp4","postrollSkipTimer":"postrollSkipTimer","popupAdShow":"no","popupImg":"popupImg","popupAdStartTime":"popupAdStartTime","popupAdEndTime":"popupAdEndTime","popupAdGoToLink":"popupAdGoToLink"}],"submit":"Save Changes","posterImg":"","posterImgOnVideoFinish":"","videoRatio":1.7769999999999999,"videoRatioStretch":false,"iOSPlaysinline":true,"videoAnimationTime":350,"progressBarThickness":3,"progressBarThicknessOnMouseover":6,"tooltipFontSize":12,"allowSkipAd":true,"showAllControls":true,"nowPlayingText":true,"autohideControls":5,"hideControlsOnMouseOut":false,"videoPlayerWidth":768,"videoPlayerHeight":432,"instanceTheme":"dark","colorAccent":"#0e1bd3","playerLayout":"fitToContainer","playerOrientation":"RTL","videoPlayerShadow":"effect1","lightBox":false,"lightBoxAutoplay":false,"lightBoxThumbnail":"","lightBoxThumbnailWidth":400,"lightBoxThumbnailHeight":220,"lightBoxCloseOnOutsideClick":true,"onFinish":"Play next video","autoplay":false,"loadRandomVideoOnStart":false,"shuffle":false,"playlist":"Off","playSpecificVideo":0,"playlistBehaviourOnPageload":"opened (default)","playlistScrollType":"light","HTML5VideoQuality":"HD","preloadSelfHosted":"none","hideVideoSource":false,"rightClickMenu":true,"youtubeControls":"custom controls","youtubeQuality":"default","youtubeShowRelatedVideos":true,"youtubeSkin":"dark","youtubeColor":"red","vimeoColor":"#00adef","showGlobalPrerollAds":false,"globalPrerollAds":"url1;url2;url3;url4;url5","globalPrerollAdsSkipTimer":5,"globalPrerollAdsGotoLink":"","nextShow":false,"rewindShow":true,"qualityShow":false,"infoShow":false,"shareShow":true,"embedShow":false,"facebookShow":true,"twitterShow":true,"mailShow":true,"facebookShareName":"\u0628\u06cc \u06a9\u0631\u0628\u0646\u0627\u062a \u0633\u062f\u06cc\u0645","facebookShareLink":"https:\/\/iranchembook.ir\/baking-soda\/","facebookShareDescription":"","facebookSharePicture":"","twitterText":"\u0628\u06cc \u06a9\u0631\u0628\u0646\u0627\u062a \u0633\u062f\u06cc\u0645","twitterLink":"https:\/\/iranchembook.ir\/baking-soda\/","twitterHashtags":"\u0628\u06cc \u06a9\u0631\u0628\u0646\u0627\u062a \u0633\u062f\u06cc\u0645","twitterVia":"","googlePlus":"https:\/\/iranchembook.ir\/baking-soda\/","embedCodeSrc":"http:\/\/yourwebsite.com\/player\/deploy\/index.html","logoShow":true,"logoPath":"","logoPosition":"bottom-left","logoClickable":true,"logoGoToLink":"https:\/\/codecanyon.net\/user\/_creativemedia","advertisementTitle":"Advertisement","skipAdvertisementText":"Skip advertisement","skipAdText":"You can skip this ad in","playBtnTooltipTxt":"\u067e\u062e\u0634","pauseBtnTooltipTxt":"\u0645\u06a9\u062b","rewindBtnTooltipTxt":"\u0628\u0627\u0632\u06af\u0634\u062a \u0628\u0647 \u0627\u0628\u062a\u062f\u0627","downloadVideoBtnTooltipTxt":"\u062f\u0627\u0646\u0644\u0648\u062f \u0648\u06cc\u062f\u0626\u0648","qualityBtnOpenedTooltipTxt":"Close quality","qualityBtnClosedTooltipTxt":"Select quality","muteBtnTooltipTxt":"\u0628\u06cc\u0635\u062f\u0627","unmuteBtnTooltipTxt":"\u0628\u0627 \u0635\u062f\u0627","fullscreenBtnTooltipTxt":"\u062a\u0645\u0627\u0645 \u0635\u0641\u062d\u0647","exitFullscreenBtnTooltipTxt":"Exit fullscreen","infoBtnTooltipTxt":"Show info","embedBtnTooltipTxt":"Embed","shareBtnTooltipTxt":"\u0627\u0634\u062a\u0631\u0627\u06a9 \u06af\u0630\u0627\u0631\u06cc \u0648\u06cc\u062f\u0626\u0648","volumeTooltipTxt":"Volume","playlistBtnClosedTooltipTxt":"Show playlist","playlistBtnOpenedTooltipTxt":"Hide playlist","facebookBtnTooltipTxt":"\u0627\u0634\u062a\u0631\u0627\u06a9 \u06af\u0630\u0627\u0631\u06cc \u062f\u0631 \u0641\u06cc\u0633\u0628\u0648\u06a9","twitterBtnTooltipTxt":"\u0627\u0634\u062a\u0631\u0627\u06a9 \u06af\u0630\u0627\u0631\u06cc \u062f\u0631 \u062a\u0648\u06cc\u06cc\u062a\u0631","googlePlusBtnTooltipTxt":"\u0627\u0634\u062a\u0631\u0627\u06a9 \u06af\u0630\u0627\u0631\u06cc \u062f\u0631 \u06af\u0648\u06af\u0644 \u067e\u0644\u0627\u0633","nextBtnTooltipTxt":"Next video","previousBtnTooltipTxt":"Previous video","playlistSearchText":"Search for video...","nextVideoInPlaylistText":"UP NEXT","autoplayNextVideoInPlaylistOn":"Autoplay next video on","autoplayNextVideoInPlaylistOff":"Autoplay next video on","countVideos":"of","copyTxt":"Copy","copiedTxt":"Copied!","shuffleBtnOnTooltipTxt":"Shuffle on","shuffleBtnOffTooltipTxt":"Shuffle off","embedWindowTitle2":"EMBED PLAYER IN YOUR SITE:","embedWindowTitle3":"SHARE CURRENT VIDEO:","videoType":"HTML5 (self-hosted)","rootFolder":"https:\/\/iranchembook.ir\/wp-content\/plugins\/Stellar-video-player\/"}
استحصال سدیم کربنات از منابع طبیعی
در این روش از ترکیبات معدنی همچون ترونا که حاوی سدیم کربنات و بی کربنات سدیم می باشند بهره برداری می شود. این روش در کشورهایی مانند آمریکا و ترکیه که دارای ذخایر بزرگ ترونا هستند، استفاده می شود. ترونا با فرمول شیمیایی Na3H(CO3)2 .2H2O از کانی های محلول در آب بوده که با افزودن گاز دی اکسید کربن به محلول آن، بی کربنات سدیم رسوب کرده و محصول نهایی تولید می گردد.
موارد کاربرد بی کربنات سدیم

1- در صنایع غذایی
از بی کربنات سدیم یا جوش شیرین به عنوان عامل ایجاد پف در برخی مواد غذایی مورد استفاده قرار می گیرد. بی کربنات سدیم می تواند نقش جایگزینی را برای بکینگ پودر داشته باشد، و حتی می تواند به صورت مخلوط با بکینگ پودر استفاده شود.

2- در صنایع شیمیایی
به منظور کنترل pH و همچنین به عنوان یک عامل بافری در صنایع شوینده قابل استفاده است.
3- در صنایع دارویی
در فرمول بندی کردن تعداد زیادی از محصولات دارویی، آرایشی و بهداشتی استفاده می شود.
4– در خوراک دام
به عنوان بافر در خوراک دام برای ثابت نگه داشتن pH معده بین 6 تا 8/6 مورد استفاده قرار می گیرد. بی کربنات سدیم پر استفاده ترین و مؤثرترین بافر برای pH معده به شمار می رود.
5- در کپسول های خاموش کننده آتش نشانی
6- در مواردی همچون تصفیه آب، افزودنی سیمان، پارچه، چرم و … نیز استفاده می شود.
مرجع مواد شیمیایی ایران
![]() با افزودن مقدار بیشتری گاز دی اکسید کربن به محلول حاصل، بی کربنات سدیم تولید می شود که به دلیل غلظت بالا ته نشین می گردد:
با افزودن مقدار بیشتری گاز دی اکسید کربن به محلول حاصل، بی کربنات سدیم تولید می شود که به دلیل غلظت بالا ته نشین می گردد:![]() در ادامه به بررسی تولید بی کربنات سدیم از طریق روش سولوی و استحصال از منابع معدنی خواهیم پرداخت.
در ادامه به بررسی تولید بی کربنات سدیم از طریق روش سولوی و استحصال از منابع معدنی خواهیم پرداخت.![]() اهمیت این فرآیند به دلیل وجود مواد اولیه فراوان و ارزان می باشد که منجر به تولید محصولات ارزشمندی همچون سدیم کربنات و سدیم بی کربنات می گردد. البته ذکر این نکته نیز ضروری است که در سال های اخیر تنها حدود 15 درصد از کل تولید سدیم بی کربنات دنیا از طریق سنتز شیمیایی به دست آمده است و بخش اعظم این محصول از طریق استحصال از سنگ معدن ترونا به دست می آید.
اهمیت این فرآیند به دلیل وجود مواد اولیه فراوان و ارزان می باشد که منجر به تولید محصولات ارزشمندی همچون سدیم کربنات و سدیم بی کربنات می گردد. البته ذکر این نکته نیز ضروری است که در سال های اخیر تنها حدود 15 درصد از کل تولید سدیم بی کربنات دنیا از طریق سنتز شیمیایی به دست آمده است و بخش اعظم این محصول از طریق استحصال از سنگ معدن ترونا به دست می آید.![]() مورد نیاز این مرحله از تجزیه حرارتی سنگ آهک (کلسیم کربنات) به دست می آید.
مورد نیاز این مرحله از تجزیه حرارتی سنگ آهک (کلسیم کربنات) به دست می آید.![]() در اثر حرارت دادن سنگ آهک، علاوه بر دی اکسید کربن، اکسید کلسیم نیز به دست می آید که از آن در بخش بازیافت آمونیاک استفاده خواهد شد. محصول حاصل از این فرآیند، بی کربنات سدیم و محلول آمونیوم کلرید می باشد که با عبور از فیلتر، بی کربنات سدیم آن جدا شده و به مرحله بعدی تولید کربنات سدیم منتقل می شود.
در اثر حرارت دادن سنگ آهک، علاوه بر دی اکسید کربن، اکسید کلسیم نیز به دست می آید که از آن در بخش بازیافت آمونیاک استفاده خواهد شد. محصول حاصل از این فرآیند، بی کربنات سدیم و محلول آمونیوم کلرید می باشد که با عبور از فیلتر، بی کربنات سدیم آن جدا شده و به مرحله بعدی تولید کربنات سدیم منتقل می شود. مرحله سوم: تولید بی کربنات سدیم
مرحله سوم: تولید بی کربنات سدیم بازیافت آمونیاک
بازیافت آمونیاک![]() اگر چه همانطور که ملاحظه می شود، در مرحله دوم طی فرآیند تولید کربنات سدیم، بی کربنات سدیم نیز به عنوان یک محصول جانبی تولید می گردد. اما بر اساس تحقیقات و بررسی های صورت گرفته تولید بی کربنات سدیم از کربنات سدیم بسیار اقتصادی تر است از این که بی کربنات سدیم را در مرحله دوم سنتز کربنات سدیم جداسازی و خالص سازی شود.
اگر چه همانطور که ملاحظه می شود، در مرحله دوم طی فرآیند تولید کربنات سدیم، بی کربنات سدیم نیز به عنوان یک محصول جانبی تولید می گردد. اما بر اساس تحقیقات و بررسی های صورت گرفته تولید بی کربنات سدیم از کربنات سدیم بسیار اقتصادی تر است از این که بی کربنات سدیم را در مرحله دوم سنتز کربنات سدیم جداسازی و خالص سازی شود.




6 دیدگاه. ارسال دیدگاه جدید
سلام و احترام
سپاسگزارم از مطالب ارزشمندی که در اختیار دانش پژوهان قرار داده اید . آرزوی سلامتی و شادکامی برای شما دارم . امیدوارم در این راه ثابت قدم و استوار بمانید .
سلام و درود؛ سپاسگزارم از نظر محبت آمیز شما کاربر گرامی
سلام فراورده حل شدن جوش شیرین در اب چیه؟
سلام و احترام، سدیم هیدروژن کربنات (سدیم بیکربنات یا جوش شیرین) یک باز ضعیف بوده و در آب به کربنیک اسید تبدیل می شود و از آنجا که کربنیک اسید بسیار ناپایدار است به آب و کربن دی اکسید تبدیل می شود.
NaHCO3 ——> H2CO3 + NaOH
H2CO3 ——> H2O + CO2
با عرض سلام بسیار عالی است خداوند متعال انشاالله شما را موفق کند که بیشتر در جهت خدمت به جامعه امروز ایران و پیشرفت علمی دانشجویان و مردم عادی قدم بردارید و طول عمر و موفقیت شما را از خداوند متعال خواستارم
سلام و درود، بسیار سپاسگزاریم از پیام محبت آمیز شما دوست عزیز