| نام شیمیایی | نیتریک اسید |
| مترادف ها (en) | Aqua fortis ؛ Spirit of niter ؛ Hydrogen nitrate ؛ Acidum nitricum |
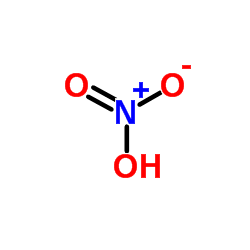
| فرمول مولکولی | HNO3 |
| جرم مولکولی | 63/01 |
| EINECS | 231-714-2 |
نیتریک اسید – Nitric acid
| شیمی پل | اطلاعات شرکت |
| پتروشیمی کارون | اطلاعات شرکت |
| پتروشیمی شیراز | اطلاعات شرکت |
| کیمیا تهران اسید | اطلاعات شرکت |
| آسان کم | اطلاعات شرکت |
اگر شما تولید کننده و یا فروشنده این ماده شیمیایی هستید…

خواص فیزیکی و شیمیایی
| شکل و حالت فیزیکی | مایع بی رنگ و شفاف |
| نقطه ذوب | -42 ºC |
| نقطه جوش | 83 ºC |
| دانسیته | 1/5129 g/cm3 |
| فشار بخار | 48 mmHg(20°C) |
| دانسیته بخار | 2/2 (vs air) |
| ضریب شکست (n20/D) | 1/397 (16/5°C) |
| دمای نگهداری | 2-8 ºC |
| حلالیت در آب | محلول در آب |
| ویسکوزیته | 1/092 mPa.s |
| ممان دوقطبی | 2/17±0/02 D |
| اسیدیته (pka) | -1/4 |
| شماره CAS | 7697-37-2 |
| شماره مرک (Merck) | 14,6577 |
موارد مصرف و روش سنتز
نیتریک اسید مایعی بی رنگ یا متمایل به زرد، خورنده، سمی و امتزاج پذیر با آب که به دو شکل مونو هیدرات و تری هیدرات یافت می شود. به عنوان اکسید کننده قوی با بسیاری از مواد آلی واکنش می دهد. از اسید نیتریک برای افزودن گروه نیترو به مولکول های آلی استفاده می شود. اسید نیتریک به دو صورت 68 درصد و 86 درصد در بازار عرضه می شود. اسید نیتریک با اکثر فلزات واکنش می دهد و نیترات فلز را به وجود می آورد. همچنین می تواند فلزات غیر فعال مانند مس و نقره را نیز اکسید کند. این اسید در اثر نور و گرما تجزیه می شود و به NO2 قهوه ای رنگ تبدیل می شود که این ترکیب در اسید نیتریک به رنگ زرد و یا حتی قرمز رنگ حل می شود. با توجه به قدرت بالای اکسید کنندگی اسید نیتریک در هنگام تماس با ترکیباتی مانند سیانیدها و کاربیدها می تواند به راحتی باعث انفجار شود.
سنتز نیتریک اسید
اسید نیتریک با واکنش دی اکسید نیتروژن با آب به دست می آید. در این روش NO تولید شده توسط اکسیژن هوا برای تولید دی اکسید نیتروژن اضافه دوباره اکسید می شود. دی اکسید نیتروژن به وسیله پراکسید هیدروژن به اسید تبدیل می شود. در حال حاضر اسید نیتریک به طور صنعتی از آمونیاک تهیه می شود. در این فرآیند آمونیاک بدون آب در حضور کاتالیزور پلاتین یا رودیوم در دمای بالا به NO اکسید می شود. سپس NO با اکسیژن هوا واکنش داده و به NO2 تبدیل می شود و در ادامه واکنش با اضافه کردن آب به واکنش اسید نیتریک به دست می آید. در آزمایشگاه نیز می توان اسید نیتریک سنتز کرد. از تجزیه حرارتی نیترات مس (II)، گاز NO2 و O2 به دست می آید و سپس با افزودن آب به واکنش اسید نیتریک تهیه می شود. همچنین از واکنش نیترات سدیم و اسید سولفوریک، NaHSO4 و HNO3 به دست می آید. در این فرآیند NaHSO4 رسوب داده و ته نشین می شود.
کاربردهای نیتریک اسید
اسید نیتریک به طور عمده برای تهیه کود استفاده می شود. همچنین در سنتز مواد شیمایی (مشتفات آنیلین، اسید آدیپیک، نیترات آمونیوم، نیترات نقره و …)، مواد منفجره، متالوژی، حکاکی، سوخت موشک ها، چاپ، خالص سازی فلزات، قلم زنی و شناورسازی سنگ معدن به کار می رود.
| Hazads Codes | C,O,Xi,T+ |
| Risk Statements | 8-35-34-20-41-37/38-36/38-26/27 |
| Saftey Statement | 23-26-36-45-36/37/39-39-60-28 |
| done_outline RIDADR | UN 3264 8/PG 3 |
| done_outline RTECS | QU5900000 |
| done_outline Fluka Brand F Code | 8 |
| done_outline Hazard Class | 8 |
| done_outline Packing Group | II |
راهنمای کدهای ایمنی مواد شیمیایی
- لوزی خطر (NFPA’s Hazard Rating Diamond) چیست؟
- چقدر با نکات ایمنی (هشدارهای R) و احتیاط های ایمنی (هشدارهای S) آشنا هستید؟